Benvenuto su DeaNet la Dea del Sesso online dove potrai trovare Recensioni su Siti di Incontri per Adulti, una sezione Informativa ed una sezione di Annunci Gratuiti per Incontri.
Chat Incontri Gay
Chat Incontri Gay : Le Chat per Incontri Gay ti permettono di trovare il partner ideale per te. Scopri come funzionano le Chat Incontri Gay.
Cerchi un Incontro Gay a Milano? Visita gay.milano.it
www.planetromeo.com Recensione di Planet Romeo (GayRomeo)
www.planetromeo.com : recensione del sito di incontri Gay Planet Romeo. Scopri l’ex GayRomeo per conoscere ed incontrare nuovi contatti Gay.
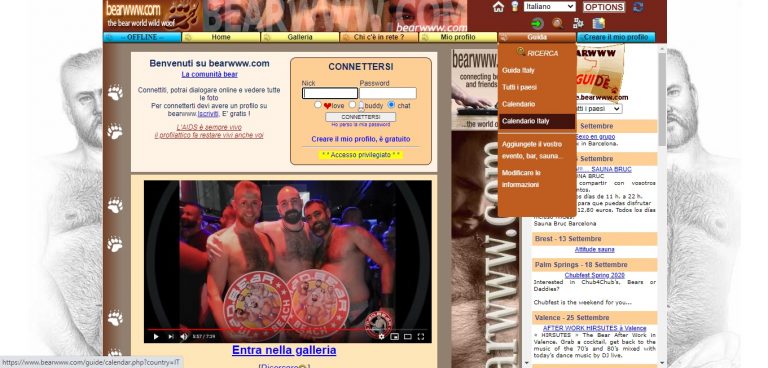
bearwww.com: Recensione Sito Gay Bear www.bearwww.com
bearwww.com: Recensione del Sito Gay Bear www.bearwww.com. Scopri come funziona la app chat bear e la bear community insieme a tanti annunci gay bear.
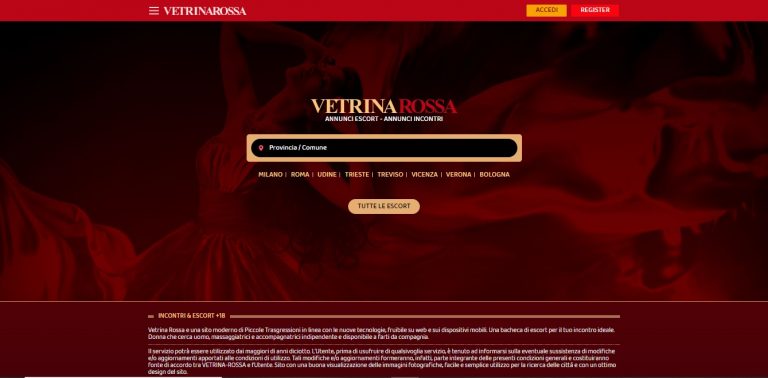
Vetrina Rossa – Recensione Sito di Incontri vetrinarossa.com
Vetrina Rossa, presente su vetrinarossa.com è il sito di annunci per incontri di sesso con escort donne e trans. Scopri la recensione su Vetrina Rossa.
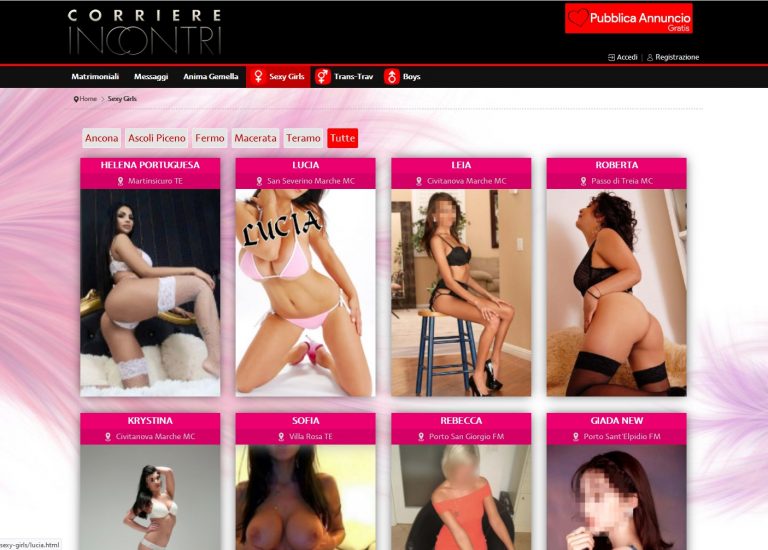
Corriere Incontri – Recensione Sito di Incontri www.corriereincontri.it
Corriere Incontri che puoi trovare sul sito www.corriereincontri.it è un portale dedicato ad annunci per incontri di amicizia, sesso o anche matrimonio.
MorenaSex – Recensione Sito di Incontri morenasex.net
MorenaSex è uno dei migliori siti di incontri in Italia con annunci gratuiti. Su morenasex.net troverai annunci, video, racconti e consigli sul sesso.
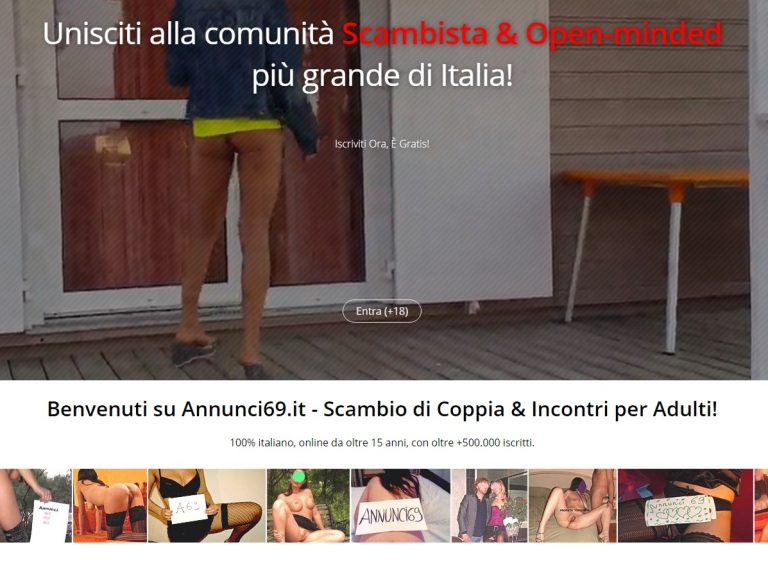
Annunci69.it – Recensione del Sito di Incontri Annunci69
Annunci69.it – Scopri la Recensione del sito di Incontri Annunci69 – Scambi di Coppia, Incontri per Sesso, racconti Erotici, Video Amatoriali e tanto altro.